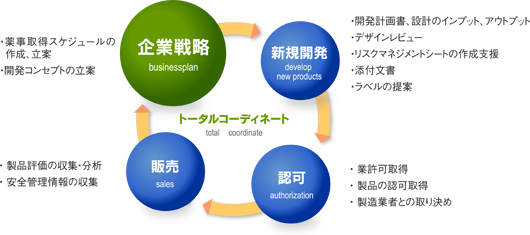
企業の薬事パートナーとして、最良のアウトソーシングを提供する。医療機器に関する薬事的な課題のすべてを視野に入れた一貫サービスで、私たちはあらゆるご要望にお応えします。



医療機器の製造販売、製造業に必要なシステム構築、維持支援
医療機器の製造販売業者は、GQP省令、GVP省令に基づいて、医療機器の品質保証、安全管理の体制を整えなければなりません。また、製造業者はクラスⅡ以上の製品を扱う場合は、全社的にQMS省令(品質マネジメントシステム)に適合していることが要求されています。海外に輸出する場合は、海外の規制に沿つてMDD(EU医療機器指令)、QSR(FDA)に適合していることが要求されています。
1.製造販売業、製造業者のシステム構築、維持支援いたします。
GQP省令、GVP省令、QMS省令に沿つて、各事業者の現状を考慮して、シンプルに構築します。
2.バリデーション、リスクマネジメントなど関連するシステムを構築、維持支援いたします。
減菌バリデーション、プロセスバリデーション(クリーンルーム、シールなど)、リスクマネジメント、設計開発、内部監査/自己点検などの実施支援など。
3. MDD(EU医療機器指令)、OSR(FDA)のシステム構築、維持支援いたします。
国内・海外の規制をミックスして構築も可能です。

必要な時に必要な支援サービス、事業者様の人件費などのコストダウンに役立ち、スピーディーな製品の市場への投入を可能にします。
1.製造販売業、製造業などの許可申請手続きを支援いたします。
医療機器の製造や販売を行うには、各都道府県への業許可の申請が必要になります。
当社が、医療機器に関する申請手続きをお客様と一緒にサポートいたします。
2.医療機器ごとに必要な品目の承認・申請手続きを支援いたします。
製造販売業などの業者としての許可を取得しても、医療機器そのものの承認・認証等手続きを行わなければ販売することができません。当社では、製造販売業の許可手続きの後に、品目の承認・認証等の手続きを支援いたします。
3.医療機器の輸出入に必要な申請手続きを支援いたします。
・海外に輸出する際の輸出届、輸入する際の輸入届出等の手続き
・510k、CEマーキングの許認可の手続き
4.医療機器の製造販売業、製造業に必要なシステム維持を支援します。
・内部監査の実施支援
・設計開発、リスクマネジメント、バリデーションの実施など

ISO13485は、1996年に医療機器製造に関する特別要求事項を含んだ品質マネジメントシステムのセクター規格として制定されました。
2003年7月に改訂を受け、独立した品質マネジメントシステムとして発行されています。
この規格改訂を受けて厚生労働省では、薬事法の改正が進められ、2005年4月に制定されました。
特に、製造業においては、医療機器の製造管理及び品質管理に関する省令や改正薬事法等への対応が必要になってきます。
また、第三者認証制度が導入され、該当する組織は厚生労働省が認めた審査登録機関によって組織における活動の適合性ならびに製品に関して審査を受けることになります。
このISO13485(品質マネジメントシステム)は、他に存在するISO9001(品質マネジメントシステム)などと比較して規格の要求事項が多く、システム構築には知識・経験が不可欠です。
当社では、品質マネジメントシステムに精通した、経験豊富なコンサルタントにて認証取得をご支援いたします。